|
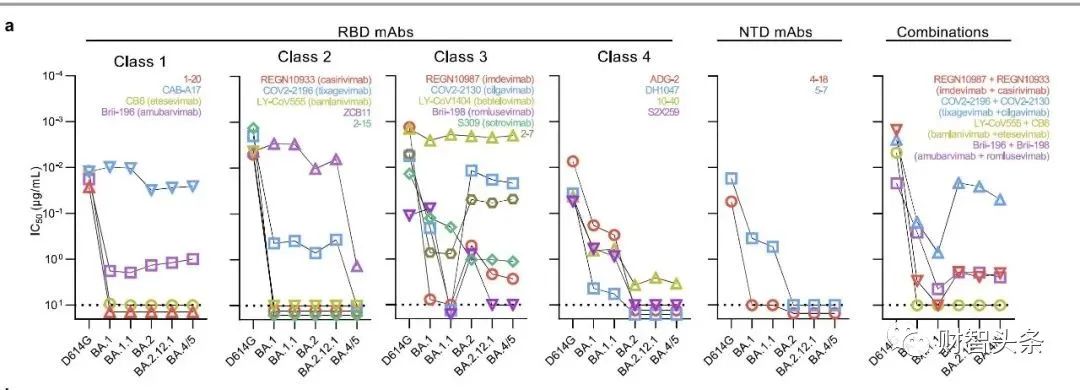
7月7日,长效新冠中和抗体安巴韦单抗和罗米司韦单抗联合疗法,正式在中国商业化上市。该联合疗法,是中国首个全自主研发的新冠病毒中和抗体联合治疗药物。 7月8日,该款联合治疗药物的生产企业腾盛博药召开发布会,介绍药物有效性、应用前景等情况。据腾盛博药方面透露的该药物定价方面的信息,2克剂量国内售价不高于1万元人民币。腾盛博药总裁兼大中华区总经理罗永庆表示,海外同类产品一般采取政府采购的模式,每人份在1500-2000美元区间,腾盛博药的联合疗法将定价在1万元人民币以内,低于全球水平。 当日下午,腾盛博药股价上涨超过12%。 回应奥密克戎逃逸之争 在治疗过程中,这对中和抗体主要是通过静脉注射的方式,两个药品各用1g先后注射,全程不足一小时,只需要一次就可以完成治疗。 去年12月8日,安巴韦单抗和罗米司韦单抗联合疗法获得国家药品监督管理局(NMPA)上市批准,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重≥40 kg)新型冠状病毒感染患者。 对于外界高度关注的中和抗体对奥密克戎新变异株的预防效果,腾盛博药方面公布数据称,安巴韦单抗和罗米司韦单抗联合疗法中和奥密克戎BA.4/5的活性和BA.2相似,药代动力学模型显示,单次注射一周后,血药浓度IC50(50%病毒抑制率)大于100倍,IC90(90%病毒抑制率)接近20倍,说明针对奥密克戎BA.4/5保持有效性。 腾盛博药方面表示,根据美国国立卫生研究院(NIH)/美国国家过敏和传染病研究所(NIAID)支持的包括837例入组门诊患者的ACTIV-2研究三期临床试验最终结果显示,与安慰剂相比,长效安巴韦单抗和罗米司韦单抗联合疗法使临床进展高风险的新冠门诊患者住院和死亡风险降低80%,具有统计学显著性。截至28天的临床终点,治疗组为零死亡而安慰剂组有9例死亡,并且其临床安全性优于安慰剂组。同时,无论早期即开始接受治疗(症状出现后5天内)还是晚期才开始接受治疗(症状出现后6至10天内)的患者,住院和死亡率均显著降低,这为新冠患者提供了更长的治疗窗口期。 不过,此前美国哥伦比亚大学病毒专家何大一教授实验室数据显示,包括安巴韦单抗和罗米司韦单抗联合疗法在内的抗体都会在一定程度被奥密克戎变异株逃逸。上个月,北京大学和昌平实验室谢晓亮教授团队在《自然》杂志上发表研究论文数据也显示,安巴韦单抗和罗米司韦单抗联合疗法无法针对奥密克戎变异株产生有效的中和作用。
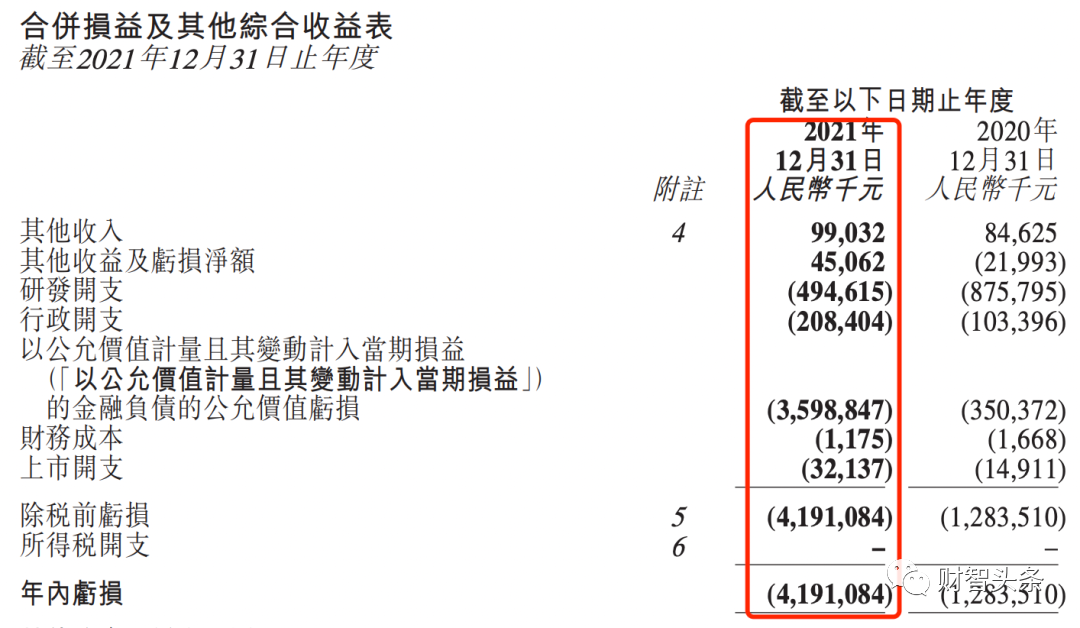
对此,腾盛博药高级副总裁、生物制药部门负责人朱青博士说:“包括何大一教授的实验室在内的中和试验都是病毒体外检测,每个实验室的检测结果不同,虽然安巴韦单抗和罗米司韦单抗联合疗法针对奥密克戎的活性降低,但还是保留了一部分活性。” 腾盛博药方面还称,除了药代动力学模型,加大剂量也能增强抗病毒疗效。公司高管在发布会上介绍,即使在单药给3克的情况下,数据证明也是安全耐受的。“即便新冠有新的变异,我们的抗体也仍然可以有效应对。” 加快推进商业化 安巴韦单抗和罗米司韦单抗的经销商包括国药控股、上药集团、华润等。罗永庆表示,除了传统的商业模式,政府采购也是一大销售途径。腾盛博药正在内部考虑,并且与一些合作伙伴讨论,如何加快联合疗法的商业化。据公司方面透露,其正在与相关部门商讨将该药物作为国家战略储备。下一步,腾盛博药将通过华润医药、上海医药和国药控股三家经销商,将药物分发到全国,医院可提出采购申请。7月7日,首批数千人份药物发往深圳市第三人民医院。 “这个产品有非常大的特殊性,新冠药物都是由政府主导,所以它既有传统的商业化模式,也有政府采购模式,我们现在与国内最大的几家经销商包括华润医药、上药控股和国药控股合作,通过他们基本上能做到覆盖全国,将药品分发到全国各地有疫情、有需求的地方。但传统商业化的一些手段比如互联网,可能不一定完全适用于这个产品。”罗永庆表示。 据罗永庆介绍,目前,现在无论哪个地方发现了疫情、有任何需求,都会第一时间通过各种渠道反映到政府,政府就会来采购。“我们已经收到了20多个省市的需求。” 关于产能情况,罗永庆表示,商业化上市以后,公司会根据国内和国外市场的需求来制定生产计划。目前,安巴韦单抗/罗米司韦单抗委任CDMO药明生物生产,药明生物具备非常大的产能,但具体的产量还要取决于未来新冠疫情的变化、国家防控政策以及病毒的致病率、传染率的因素。 业绩回报非重要考量 自2017年成立以来,腾盛博药已建立起一条针对感染性疾病及中枢神经系统疾病,由十多个创新候选产品组成的研发管线。2021年7月,腾盛博药登陆港交所。不过目前,腾盛博药尚未实现盈利。根据2021年财报,该公司亏损41.91亿元,亏损额相较上年增加约29亿元。 从财报来看,其于去年12月8日上市的新冠药物并未录得收入,同时又因首年上市,为持有优先股的早期投资者兑现了一定财务支出(该亏损无需现金流出,完全是一种财务处理),排除这部分费用,实际上的经营亏损约5.9亿元,处于一家创新药企的合理费用范围。 众所周知,创新药研发是一项高投入、高产出,同时保持高风险的多方博弈游戏。自港股18A开放以来,从近年财报来看,港股近20家上市Biotech,无一例外都在赔钱,上亿、甚至数十亿的亏损比比皆是,创业史几乎相当于烧钱史。这些烧钱的公司共性是研发投入占有大部分比例,腾盛博药也不例外。
安巴韦单抗/罗米司韦单抗作为重磅商业化产品,医药行业投资人士李顼表示,由于国内疫情控制良好,上述药物能为公司带来多大营收仍是未知数,需要关注该产品后续在海外尤其美国的申报情况。 罗永庆表示,在研发安巴韦单抗和罗米司韦单抗的时候,公司前后投入了超过2亿美元以确保研发和商业化的顺利进行。至于该款药物能带来的业绩回报,不是公司最重要的考虑因素。“腾盛博药在2020年投入研发的时候,更多的是希望能够帮助到全球的抗疫,经济回报当时肯定不是我们最重要的考量。当然作为一家企业,我们也在寻求可持续的研发和发展。” 2021年10月初,腾盛博药向美国FDA提交了这款联合疗法紧急使用授权申请,用于临床进展为重度疾病高风险的COVID-19门诊患者的治疗。罗永庆表示,FDA已经对材料进行了审核,但除了审核临床试验数据,FDA还要对生产现场进行核查,目前由于疫情带来的诸多限制,FDA到中国核查生产现场的时间还不确定。 (微信公众号“财智头条”综合自:央广网、第一财经、潇湘晨报等) 编辑:袁凯 校对:风华 审核:龚紫陌 |